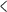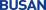유전자 가위 기술로 코로나바이러스 핵심 급소 '싹둑'"
- 가
송현수 기자 songh@busan.com
KAIST·전북대연구팀 "바이러스 증식 99.9% 억제 효과 증명”
 연구진 사진. (왼쪽부터) KAIST 생명과학과 유다슬이 연구조교수, 허원도 교수, 김지혜 선임연구원, 유정혜 박사과정. KAIST 제공
연구진 사진. (왼쪽부터) KAIST 생명과학과 유다슬이 연구조교수, 허원도 교수, 김지혜 선임연구원, 유정혜 박사과정. KAIST 제공
![[그림 1] RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략. A)코로나 바이러스 변이체에 적용가능한 유전자 가위 기술 CRISPR-Cas13의 표적 부위 선별. 진화적으로 보존된 부위를 컴퓨터 계산 및 서열 비교를 통해 선정함. B)코로나 바이러스 감염쥐에서의 효과 확인을 위한 mRNA로 제작된 CRISPR-Cas13 기술의 비강 내 투여. 비강 내 투여를 통해 mRNA가 쥐의 폐기관으로 효과적으로 전달되는 것을 확인함. C)mRNA로 제작된 유전자 가위 기술 CRISPR-Cas13의 비강 내 전달을 위한 모식도. mRNA의 안정성을 위해 지질막으로 싸여진 기술을 이용하여 mRNA를 전달함. D)세포에서 단백질로 발현된 유전자 가위 기술 CRISPR-Cas13의 코로나 바이러스 RNA 표적 및 코로나 바이러스의 pseudoknot 구조. 코로나 바이러스 변이체에서 진화적으로 보존되었으며 바이러스 복제에 필수적인 부위인 psuedoknot을 표적함으로써 효과적으로 바이러스 유전체를 분해 및 억제할 수 있었음. E)코로나 바이러스-19의 생활사 및 RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략을 통한 바이러스 유전체 분해 모식도. RNA 바이러스 복제에 필수적인 Rdrp (RNA 복제 및 전사 효소)를 표적함으로써 코로나 바이러스의 복제 및 전사를 막고 효과적인 바이러스 유전체를 분해 할 수 있음. KAIST 제공](/nas/wcms/wcms_data/photos/2023/05/01/2023050118350348138_l.png) [그림 1] RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략. A)코로나 바이러스 변이체에 적용가능한 유전자 가위 기술 CRISPR-Cas13의 표적 부위 선별. 진화적으로 보존된 부위를 컴퓨터 계산 및 서열 비교를 통해 선정함. B)코로나 바이러스 감염쥐에서의 효과 확인을 위한 mRNA로 제작된 CRISPR-Cas13 기술의 비강 내 투여. 비강 내 투여를 통해 mRNA가 쥐의 폐기관으로 효과적으로 전달되는 것을 확인함. C)mRNA로 제작된 유전자 가위 기술 CRISPR-Cas13의 비강 내 전달을 위한 모식도. mRNA의 안정성을 위해 지질막으로 싸여진 기술을 이용하여 mRNA를 전달함. D)세포에서 단백질로 발현된 유전자 가위 기술 CRISPR-Cas13의 코로나 바이러스 RNA 표적 및 코로나 바이러스의 pseudoknot 구조. 코로나 바이러스 변이체에서 진화적으로 보존되었으며 바이러스 복제에 필수적인 부위인 psuedoknot을 표적함으로써 효과적으로 바이러스 유전체를 분해 및 억제할 수 있었음. E)코로나 바이러스-19의 생활사 및 RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략을 통한 바이러스 유전체 분해 모식도. RNA 바이러스 복제에 필수적인 Rdrp (RNA 복제 및 전사 효소)를 표적함으로써 코로나 바이러스의 복제 및 전사를 막고 효과적인 바이러스 유전체를 분해 할 수 있음. KAIST 제공
[그림 1] RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략. A)코로나 바이러스 변이체에 적용가능한 유전자 가위 기술 CRISPR-Cas13의 표적 부위 선별. 진화적으로 보존된 부위를 컴퓨터 계산 및 서열 비교를 통해 선정함. B)코로나 바이러스 감염쥐에서의 효과 확인을 위한 mRNA로 제작된 CRISPR-Cas13 기술의 비강 내 투여. 비강 내 투여를 통해 mRNA가 쥐의 폐기관으로 효과적으로 전달되는 것을 확인함. C)mRNA로 제작된 유전자 가위 기술 CRISPR-Cas13의 비강 내 전달을 위한 모식도. mRNA의 안정성을 위해 지질막으로 싸여진 기술을 이용하여 mRNA를 전달함. D)세포에서 단백질로 발현된 유전자 가위 기술 CRISPR-Cas13의 코로나 바이러스 RNA 표적 및 코로나 바이러스의 pseudoknot 구조. 코로나 바이러스 변이체에서 진화적으로 보존되었으며 바이러스 복제에 필수적인 부위인 psuedoknot을 표적함으로써 효과적으로 바이러스 유전체를 분해 및 억제할 수 있었음. E)코로나 바이러스-19의 생활사 및 RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략을 통한 바이러스 유전체 분해 모식도. RNA 바이러스 복제에 필수적인 Rdrp (RNA 복제 및 전사 효소)를 표적함으로써 코로나 바이러스의 복제 및 전사를 막고 효과적인 바이러스 유전체를 분해 할 수 있음. KAIST 제공
한국과학기술원(KAIST) 생명과학과 허원도 교수·전북대 강상민 교수 공동연구팀은 리보핵산(RNA) 유전자 가위 기술(CRISPR-Cas13)을 이용해 코로나바이러스 핵심 급소를 발견했다고 1일 밝혔다.
RNA는 데옥시리보핵산(DNA)에 담긴 유전 정보를 단백질로 바꿀 때 이를 매개하는 물질이다
![[그림 2] 슈도낫 부위 타겟 범용 치료제 처리에 따른 코로나바이러스-19 및 변이체 증식 억제. 코로나바이러스-19 변이체에서 진화적으로 보존된 Key 공략부위인 슈도낫 (pseudoknot) 구조를 타겟하는 범용 mRNA 치료제 처리에 따른 99.9퍼센트의 코로나바이러스 증식 억제 효과 및 변이체 증식 억제 비교. Vero E6 세포의 범용 치료제 비처리군, 대조군, 치료제 처리군내에서 코로나바이러스-19 뿐만 아니라 변이체 모두 증식력이 효과적으로 억제됨을 확인함. KAIST 제공](/nas/wcms/wcms_data/photos/2023/05/01/2023050118362071325_l.png) [그림 2] 슈도낫 부위 타겟 범용 치료제 처리에 따른 코로나바이러스-19 및 변이체 증식 억제. 코로나바이러스-19 변이체에서 진화적으로 보존된 Key 공략부위인 슈도낫 (pseudoknot) 구조를 타겟하는 범용 mRNA 치료제 처리에 따른 99.9퍼센트의 코로나바이러스 증식 억제 효과 및 변이체 증식 억제 비교. Vero E6 세포의 범용 치료제 비처리군, 대조군, 치료제 처리군내에서 코로나바이러스-19 뿐만 아니라 변이체 모두 증식력이 효과적으로 억제됨을 확인함. KAIST 제공
[그림 2] 슈도낫 부위 타겟 범용 치료제 처리에 따른 코로나바이러스-19 및 변이체 증식 억제. 코로나바이러스-19 변이체에서 진화적으로 보존된 Key 공략부위인 슈도낫 (pseudoknot) 구조를 타겟하는 범용 mRNA 치료제 처리에 따른 99.9퍼센트의 코로나바이러스 증식 억제 효과 및 변이체 증식 억제 비교. Vero E6 세포의 범용 치료제 비처리군, 대조군, 치료제 처리군내에서 코로나바이러스-19 뿐만 아니라 변이체 모두 증식력이 효과적으로 억제됨을 확인함. KAIST 제공
![[그림 3] RNA 유전자 가위 기술을 이용한 코로나바이러스 RNA 유전체의 Key 공략부위 슈도낫 (열쇠모양)을 타겟하는 범용 코로나 바이러스 감염병 mRNA 치료제 이미지. KAIST 제공](/nas/wcms/wcms_data/photos/2023/05/01/2023050118370033794_l.png) [그림 3] RNA 유전자 가위 기술을 이용한 코로나바이러스 RNA 유전체의 Key 공략부위 슈도낫 (열쇠모양)을 타겟하는 범용 코로나 바이러스 감염병 mRNA 치료제 이미지. KAIST 제공
[그림 3] RNA 유전자 가위 기술을 이용한 코로나바이러스 RNA 유전체의 Key 공략부위 슈도낫 (열쇠모양)을 타겟하는 범용 코로나 바이러스 감염병 mRNA 치료제 이미지. KAIST 제공
연구팀은 RNA 유전자 가위 기술로 코로나바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위(pseudoknot region)를 제거했다. 이어 전북대 인수공통감염병 연구소와 협업을 통해 동물모델에서 99.9% 이상 바이러스 증식 억제 효과가 있음을 입증했다고 설명했다. 이는 슈도낫 부위가 코로나바이러스의 가장 취약한 급소임을 보여주는 결과라고 연구팀은 덧붙였다.
연구팀 관계자는 "이 기술은 mRNA(전령 RNA) 기반 유전자 치료제를 전달하는 방식으로, DNA 기반 유전자 치료제보다 전달 효율이 매우 높고, 치료제 발현 시간 또한 매우 빠르다"며 "우리가 만든 mRNA 기반 치료제의 경우 감염 세포에는 2시간 이내, 감염 동물에는 6시간 이내 효과가 나타났다"고 설명했다.
송현수 기자 songh@busan.com
ⓒ 부산일보(www.busan.com), 무단전재 및 수집, 재배포금지
당신을 위한 AI 추천 기사
실시간 핫뉴스